以95份玉米微核心种质和3份常用玉米转基因受体材料(A188、HiII和综31)组成的关联作图群体, 对玉米再生相关候选基因
A maize association mapping population consisted of a mini core collection of ninety-five maize inbred lines and three elite maize accessions (A188, HiII, and Zong 31) usually for genetic transformation was used to analyze the sequence diversity and linkage disequilibrium (LD) of
植株再生是受多个基因调控的复杂的无性繁殖过程。已有的研究发现存在多种与植物体细胞胚胎发生有关的候选基因, 如体细胞胚胎发生相关类受体蛋白激酶(somatic embryogenesis receptor-like kinase, SERK) 基因[1]、亚硝酸还原酶(Nitrite reductase, NiR)基因[2,3]、生长素结合蛋白(Auxin Binding Protein 1, ABP1)基因[4]、抗氧化酶(superoxide dismutase, SOD)基因、细胞分裂周期相关基 因[5]( cdc2)和调控胚胎发育相关基因( leafy cotyledon 1, LEC1)等。Meinke等[6]发现在拟南芥中 LEC1在胚胎发生过程中起重要作用, LEC1编码CCAAT-box结合因子HAP3的一个亚基。Lotan等[7]证明拟南芥 LEC1基因在发育早期胚性细胞的形成中起关键作用, 是胚发育的重要调节因子并能激活胚形态发生及细胞分化所需的转录因子。在玉米中, Zhang等[8]研究表明 ZmLEC1基因在体细胞胚中的表达模式与在拟南芥合子胚中的表达模式一样, ZmLEC1基因在胚性愈伤组织中持续表达, 在球形胚状体中高表达, 说明 ZmLEC1基因与离体组织胚状体发生关系密切。玉米幼胚培养获得的胚性愈伤组织具有较强的长期继代能力和分化植株能力[9], 因而通常被用于构建转基因受体系统。目前国际上普遍利用的玉米遗传转化受体是HiII (是A188与B73的杂交种)。
由于植株再生能力具有明显的基因型依赖性, 国内外对再生能力进行了基于分子标记的遗传分 析, 并试图克隆高效再生相关基因[10]。在玉米上, Armstrong等[11]利用RFLP标记对组织培养能力进行QTL分析, 共找到3个相关性状的11个QTL。Krakowsky等[12]在利用重组近交系(RILs)群体对玉米愈伤组织诱导能力的遗传研究中, 检测到分布在8条染色体上的11个QTL, 这些位点所在的区域均含有与脱落酸代谢有关的基因。张红伟等[13]利用黄早四和Mo17为亲本组配的RIL群体, 以幼胚出愈率、II型愈伤组织诱导率、绿点及绿苗分化率作为相关性状指标, 共检测到与各性状相关的8个QTL, 分别位于第2、第3、第5、第6、第8和第9染色体。进一步发掘和利用玉米优异再生相关基因, 不但有助于提高组织培养植株再生率和遗传转化效率, 在转基因玉米新品种培育中也具有应用前景[14]。
关联分析是利用自然群体、以连锁不平衡(LD)为基础来建立性状与遗传标记或候选基因间的关系的技术方法[15], 该方法不仅是新基因发掘的有效途径, 而且也是联系结构基因组学和表型组学的一座桥梁[16]。基于候选基因的关联分析是发掘与表型变异密切相关的功能等位变异的有效手段。Thornsberry等[17]在2001年首次在植物中应用关联分析技术, 发掘出9个与玉米开花期相关的 Dwarf8多态性位点(包括5个SNPs和4个InDels)。随后关联分析广泛应用于玉米胚乳颜色[18]、淀粉合成[19]、绿原酸含量[20]、饲用品质等[21]数量性状的研究。严建兵等[22]发现β羟化酶基因( CrtRB1)可使玉米β胡萝卜素含量增加18倍, 在代谢途径中降低β胡萝卜素的同化效率, 使β胡萝卜素的含量增加。
本研究对98份材料幼胚胚性愈伤组织形成能力鉴定评价, 分析 ZmLEC1基因在目标群体中的序列多样性, 并基于候选基因关联分析策略研究 ZmLEC1基因与胚性愈伤组织形成之间的内在联系, 旨在筛选再生率高的新基因型, 探讨玉米幼胚胚性愈伤组织形成的遗传机制。
98份材料包括本实验室构建的95份自交系微核心种质[23]和3份国内外常用于玉米幼胚遗传转化的材料(自交系A188和综31, 以及杂交种HiII)。根据以前的研究, A188属于瑞德群, 综31属于P群, HiII是A188与B73的杂交种; 95份核心材料划分为4个优势类群: 兰卡斯特、塘四平头、P、瑞德群, 以及混合(mixed)群[23]。
2012年将98份材料种植于中国农业科学院作物科学研究所试验农场内。分2次播种, 其间相隔20 d以保证有充足的自交授粉幼穗。在幼穗自交授粉后9~12 d, 取回实验室, 去除苞叶, 用70%的酒精浸泡幼穗1 min, 用无菌医用刀片削去幼穗表面约0.5 cm深的籽粒, 用尖头镊子或刀片小心挑出幼胚, 幼胚的合适长度为1.0~1.2 mm[24]。将完整的幼胚摆放在诱导愈伤培养基上, 盾片向上, 每皿摆放50个左右幼胚, 每种材料5皿。暗培养2周之后将诱导出的愈伤组织转移到继代培养基上, 2周继代一次(暗培养), 继代2~3次之后胚性愈伤组织出现, 培养基配方见表1。根据Armstrong等[25]将愈伤组织质量分为3种类型, I型为乳白色或白色, 结构紧密、坚硬, 表面皱起, 生长慢, 易发生器官分化, 胚性差不易长期继代; II型淡黄色或黄色, 结构松散、易碎, 有明显的颗粒状, 易发生胚状体, 且能长期继代培养, 是理想类型; III型结构疏松, 绵软如絮, 水渍状, 白色透明或半透明, 易褐化死亡, 不具有分化能力。
| 表1 培养基配方Table 1 Formula of media |
II型胚性愈伤组织诱导率=(II型胚性愈伤组织数目/愈伤组织总数)×100%将继代2~3次之后出现的胚性愈伤组织转移到再生培养基上, 光照培养, 1周左右分化出绿色幼苗, 观察各材料间愈伤组织分化成幼苗的能力。试验所用试剂购自于北京拜尔迪生物技术有限公司。
1.3.1 目的片段的获得和测序 以NCBI中的 ZmLEC1基因序列(NM_001112048.1)为参照, 使用DNAMAN (version 5.2.9)设计引物, FP: 5-AGC CACTACTCCATCCACCACA-3, RP: 5-CCGGGAC AGAATCACAGTACAACT-3。以供试材料基因组DNA为模板, 采用高保真的Trans Taq HiFi酶(北京全式金生物技术有限公司)进行PCR扩增, 程序为: 95℃预变性5 min; 95℃ 30 s, 57℃ 30 s, 72℃ 1 min, 30个循环; 最后72℃延伸10 min; 4℃保存。选取特异性好的目标条带用试剂盒(百泰克生物公司)回收纯化, 送农作物基因资源与基因改良国家重大科学工程测序部用ABI3730XL DNA测序仪双向测序, 对每个试样测3次以保证测序结果的准确性。
1.3.2 目标片段DNA序列单核苷酸多态性检测
用Vector NTI advance 10 (Invitrogen Corporation, 2005)软件的ContigExpress对靶标序列进行拼接, 用DNAStar (version 7.10)软件包内的EditSeq去掉两端多余序列, 将得到的一致序列(consensus sequence)用ClustalX软件[26]进行对比, 并将完成比对的序列保存为 PHYLIP 格式文件, 用DNAsp5.10[27]计算Tajima’s D值, 用TASSEL[28]软件进行单核苷酸多态性分析和连锁不平衡(LD)分析。
1.3.3 关联分析 基于 ZmLEC1序列对目标群体进行LD评价和目标性状关联分析, 选取TASSEL软件的一般线性模型。当 P<0.05时, 该位点被认为与目标性状显著关联。
98份材料中有11份(掖478、京糯2号、辐842、大MO、K36、H2、X.L9010-3/O2、CML67、H205、赤黄32、55113-3-3-5)(表2)由于花期不遇或幼胚在组织培养中污染而没有数据。对表型数据方差分析显示, 不同材料之间胚性愈伤组织诱导率差异极显著, 材料各重复之间差异不显著(表3)。关联群体胚性愈伤组织诱导率的平均值是51.85%, 变幅为6.78%~98.48%, 变异系数( CV)为41.72, 峰度(Skewness)为0.02527, 偏度(Kurtosis)为-0.5046, 关联群体表型数据符合正态分布, 因此用此结果进行关联分析有可行性。
在获得表型数据的87份材料中有43份经继代和分化而得到再生幼苗, 粤267-1-1、资玉3号、HiII、A188、综31、B73、承18、旅28、齐319、黄C、郑58、黄早四等材料分化及再生能力较强, 能分化出较多幼苗, 吉63、太184、CN165、齐318、XZ19等材料分化出的幼苗较少, 且部分为畸形苗。8份P群材料(综31、齐319、遵90110、沈135等)诱导胚性愈伤组织率较高, 平均胚愈率为59.74%, 且P群诱导的愈伤组织大多都能分化出绿色幼苗, 再生能力较好。12份瑞德群材料的平均胚愈率为39.89%, 其中将近半数(掖8112、5003、辽7794、FR218、Lo1125)胚愈率都低于20%, 且愈伤组织质量较差, 大部分不能再生出幼苗。28份兰卡斯特群的材料平均胚愈率是50.91%, 13份塘四平头群材料的平均胚愈率是50.29%, 兰卡斯特和塘四平头类群材料都既有胚性愈伤组织形成率高的材料又有胚愈率低的材料。胚性愈伤组织形成能力较强的粤267-1-1、资玉3号、92黄7、黄C属于混合群。
| 表2 98份材料胚性愈伤组诱导织率Table 2 Embryogenic calli formation frequency of the 98 accessions |
| 表3 胚性愈伤组织诱导率方差分析Table 3 Analysis of variance for induction percentage of the embryogenic callus |
2.2.1 ZmLEC1基因组DNA全长及基因结构 以玉米自交系B73为参照(图1), ZmLEC1位于玉米第5条染色体上, 对 ZmLEC1的结构分析表明, 编码区自起始密码子(ATG)至终止密码子(TAG)长837 bp, 由一个外显子组成, 无内含子。
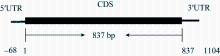 | 图1 玉米 ZmLEC1基因结构UTR: 非翻译区; CDS: 编码序列。Fig. 1 Structure of Zm LEC1in maizeUTR: un-translated region; CDS: coding sequence. |
2.2.2 ZmLEC1基因的序列多态性及单倍型分析
98份材料中有2份没有得到扩增产物, HiII为杂交种不用测序, 因此共获得95份材料的 ZmLEC1序列。用TASSEL软件分析序列多样性及LD, 发现在编码区共检测到42个多态性位点, 其中包括33个单核苷酸多态性(SNP)和9个插入缺失多态性(InDel), 平均每26 bp检测到一个SNP, 每95 bp检测到一个InDel, 在 ZmLEC1整个分析区域的单核苷酸变异频率为平均每21 bp就有一个多态性位点。32个多态性位点中有29个多态性位点发生了非同义突变, 从而引起了氨基酸的改变, 10个多态性位点发生了同义突变, 没有引起氨基酸的改变。核苷酸多态性 π值为0.01037, θw值为0.00799。Tajima’s D值为0.91698, 未达到显著水平。
该基因14种单倍型中, 胚性愈伤组织形成能力强的几种材料资玉3号、沈135、遵90110属于单倍型8 (平均胚性愈伤组织形成率59.71%), 粤267-1-1、综31、齐319、黄C属于单倍型9 (平均胚愈率72.06%), A188属于单倍型10 (平均胚愈率54.90%), 抚96、丹340属于单倍型11 (平均胚愈率67.18%), 比较这几种单倍型的多态性位点发现, 单倍型8、9、10、11与其他单倍型相比在位点501、528发生了C/G转换, 其中528位点发生了氨基酸变异, 由组氨酸变为谷氨酰胺, 并且在位点539处发生了3个碱基的缺失。
对 ZmLEC1基因中的多态性(SNP和InDel)间LD的分析表明, 处于显著LD状态的相邻多态性位点几乎遍布整个基因序列(图2)。位点40和53、54、57; 73和77; 90和91、92; 391和419、434、440、442; 445和446、447; 448和449、450; 454和455、456、457、458、459; 501和528; 534和535、536; 539和540、541; 594和595、596、597、598、599、600、601、602、642、643、644、645; 718和729; 735和736、737、738、739、740、741、742、743; 846和847、848、849、850、851、852之间均存在较强的连锁不平衡结构( R2>0.9)。
对 ZmLEC1基因的序列多态性位点进行连锁不平衡分析, 以位点距离和连锁不平衡参数 R2 (squared allele-frequency correlations)作散点图表明, ZmLEC1在300 bp处 R2为0.1, 随着遗传距离的增加, R2小于0.1水平, 即说明本研究群体该基因的LD衰减速度较快。
关联分析共检测到4个与胚性愈伤组织显著关联的位点, 其中1个位点达到显著水平, 位于基因的466位点, 而另外3个位点则达到极显著水平, 分别位于基因的501、528、539位点(表5)。在显著关联的4个位点中, 位点501(G/C)、528(G/C)以及539 (InDel)处于完全LD状态, 位点528G/C的转换引起了组氨酸和谷氨酰胺的改变, 539(ACC)的插入/缺失引起了一个组氨酸的插入/缺失, 位点528、539可能是引起表型变异的位点, 其位点贡献率为9.9272%; 位点466T/G的颠换引起了丝氨酸和丙氨酸的改变, 其位点贡献率为6.0656%。
| 表4 95份材料 ZmLEC1基因的单倍型Table 4 Haplotypes of ZmLEC1 among 95 maize accessions |
 | 图2 ZmLEC1基因多态性位点间的连锁不平衡(*表示显著性位点)Fig. 2 Linkage disequilibrium between pairs of ZmLEC1sequence polymorphic sites (* Significant sites) |
 | 图3 ZmLEC1基因多态性间的连锁不平衡衰退Fig. 3 Decay of LD between pairs of ZmLEC1 sequence informative polymorphisms |
| 表5 ZmLEC1基因多态性位点与表型性状的关联分析Table 5 Association analysis between ZmLEC1 polymorphic sites and phenotypic trait |
“—”为无氨基酸改变, “/”为氨基酸改变, “/-”为氨基酸插入或缺失.
“—”: no amino acid change, “/”: amino acid change, “/-”: amino acid indel.
本研究供试的材料在相同的培养条件下胚性愈伤组织形成率从最低的6.78%到最高的98.48%不等, 给基因型依赖是玉米幼胚愈伤组织发生及器官建成的重要制约因子这一观点提供了新证据。研究发现, 粤267-1-1的胚性愈伤组织诱导率高达98.48%, 其继代及分化出绿色幼苗的能力强。目前应用于玉米幼胚遗传转化的材料仅限于少数几种, 如A188[25]、HiII[29]、H99[30]、综31[31]等, 今后可将粤267-1-1作为一种新的遗传转化受体, 扩大应用范围。
前人对不同基因型玉米幼胚离体培养筛选适合组培的基因型, 但是由于培养基等培养条件存在差异, 不同研究者所得出的结论不尽一致。本研究结果表明HiII、A188、综31、B73、郑58[32]、齐319等一些常用于幼胚培养的材料胚性愈伤组织形成率高, 与多数学者结论比较一致[31]。对个别不常用于幼胚培养的材料(如昌7-2、48-2等)观点存在差异, 在本研究中昌7-2胚性愈伤组织诱导率为60.21%且易分化出绿色幼苗, 与胡彦民等[33]认为昌7-2能产生易再生植株的II型愈伤组织结论一致, 而王汉宁等[34]对6个玉米自交系幼胚培养研究认为昌7-2表现最差, 愈伤组织诱导率≤25%。这可能是培养基和培养环境不同所致, 从另一方面也证明基因型是影响玉米幼胚培养的主要控制因子, 培养条件是重要的外部因素。Duncan等[9]用101份自交系、群体以及杂交种等遗传来源较广泛的材料, 及N6、B5、MS等多种培养基和不同的激素种类与水平进行实验, 表明玉米组织培养再生能力在基因型间存在显著差异, 仅有49%的基因型能够产生能再生出植株的胚性愈伤组织。吴红等[35]对49个玉米自交系进行幼胚培养, 其中有15个自交系能诱导出胚性愈伤组织最终再生成植株。本研究所用试验材料具有广泛的遗传多样性, 幼苗再生比例(49.4%)高于吴红等的研究而与Duncan等的研究结果接近。
本试验中胚性愈伤组织形成能力较强的HiII、粤267-1-1、资玉3号、92黄7、黄C属于混合类群, 其中HiII是A188 (P群)和B73 (瑞德亚群)的杂交种。母贵琴等[36]对53份玉米材料(自交系24份, 杂交组合29份)幼胚培养发现, F1杂种的胚性愈伤组织诱导率具有明显的杂种优势。因此, HiII的高胚性愈伤组织诱导率和高再生能力可能与杂种优势有关。粤267-1-1与塘四平头亚群和瑞德亚群有53.9%和44.9%的遗传相似性; 资玉3号与兰卡斯特亚群和瑞德亚群有76.3%和21.1%的相似性; 92黄7与兰卡斯特亚群和塘四平头亚群有70.9%和26.8%的相似性; 黄C与瑞德和塘四平头有73.4%和25.7%的相似性[23]。因此, 粤267-1-1、资玉3号、92黄7、黄C可能是综合了不同遗传背景中的与再生能力相关的基因从而拥有较高的胚性愈伤组织形成能力和再生能力。
本研究结果表明, ZmLEC1基因在扩增出的95份材料中拥有较高的核苷酸多样性水平。 ZmLEC1序列中的42个多态性位点中包含33个SNPs和9个InDels。Ching等[37]对36份自交系18个基因研究表明, 每61 bp存在一个SNP, 每126 bp存在一个Indel。Jung等[38]研究中检测到每83~104 bp出现一个SNP, 186 bp出现一个InDel。本研究 ZmLEC1基因中SNP、InDel频率均高于玉米中SNP、InDel的平均水平, 与Tenaillon等对一组多样性玉米种质调查其序列多样性的研究结果接近(在14 420 bp中检测到522个SNP位点, 平均每27.6 bp存在一个SNP位点), 这与本研究选用的材料具有广泛的遗传多样性有关。
利用 ZmLEC1序列中的SNP位点作Tajima D测验, 目的是鉴定目标DNA序列在进化过程中是否遵循中性进化模型。在中性进化条件下, θw和 π值应该近似相等。因此在标准中性进化模型下, Tajima D的理论值为零。在本试验中的 Tajima D值为0.91698, 未达到显著水平, 表明 ZmLEC1基因在进化过程中经受的选择作用较小, 未偏离中性进化, 没有发生纯化选择。另外, ZmLEC1的Tajima D值为正值, 表明群体中存在较多中等频率的等位基因, 可能是存在群体结构、经历瓶颈效应或平衡选择的结果。因此, 可以认为 ZmLEC1基因在进化中受到自然和人工选择、遗传漂变等因素的影响较小。
玉米为异交作物, 有效重组率高, 重组导致连锁的位点彼此独立存在, 从而减弱了染色体内部的LD[38], 因此LD的衰退一般比较迅速[39]。Remington等[40]研究表明在具有广泛变异的玉米白交系中的LD衰退距离是1.5 kb, Tenaillon等[41]研究显示第1染色体上21个位点均存在LD的快速衰退, 平均在100~200 bp以内。本研究中 ZmLEC1基因大约在300 bp处衰减到 R2=0.1水平, 由于本研究选用的材料是来自玉米核心种质的一组能最大限度代表我国玉米遗传多样性的自交系, 这组自交系具有广泛的遗传多样性, 因此利用这组种质检测到的候选基因的LD水平也相应较低一些, 与前人研究结果接近。本研究中 ZmLEC1基因区域检测到的LD快速衰退, 也暗示着利用该候选基因的序列多态性进行关联研究, 将具有较高的分辨率。
3.4 ZmLEC1基因的多态性与表型性状的关联分析
连锁不平衡分析和关联分析发现基于单倍型的分析比基于单个SNP分析可提供更多的生物学信息, 并且在分析SNP—性状关联时更为有效。在 ZmLEC1基因编码序列中一些多态性位点引起了胚性愈伤组织形成的表型差异, 在显著关联的4个位点中, 位点501 (G/C)、528 (G/C)以及539 (InDel)处于完全LD状态, 组成一个单倍型, 其中位点528G/C的转换引起了组氨酸和谷氨酰胺的改变, 胚性愈伤组织形成能力强的第8、第9、第10、第11单倍型在位点528处为G, 编码谷氨酰胺, 并且在539处有3个碱基的缺失, 从而引起了一个组氨酸的缺失, 501位点G/C的转换并没有引起氨基酸的改变, 因此, 位点528、539可能是引起表型变异的位点, 其位点贡献率为9.9272%; 位点466T/G的颠换引起了丝氨酸和丙氨酸的改变, 可能也是引起表型变异的关键位点, 其位点贡献率为6.0656%, 因此其SNP也可作为一种分子标记来筛选胚性愈伤组织形成能力强的基因型; 42个多态性位点中有32个发生了非同义突变, 从而引起了氨基酸的改变, 10个发生了同义突变, 没有引起氨基酸的改变, 这种推测只是根据基因编码的核酸序列变化, ZmLEC1基因在复制、转录、翻译及翻译后是否受到其他因素调控从而与原来的参考序列在蛋白质一级乃至高级结构上是否发生改变, 尚需研究验证。胚性愈伤组织形成本身是个复杂的过程, 是受多基因调控的数量性状。本试验在关联分析时仅用了一个玉米再生相关候选基因 ZmLEC1, 得出的结果尚需进一步验证。
自交系粤267-1-1诱导出的愈伤与杂交种HiII诱导出的愈伤组织极为相似, 都是再生能力好的II型愈伤, 可作为玉米幼胚遗传转化的替代受体材料, 也有利于转化基因的回交转育。针对资玉3号、92黄7、黄C、威风322、黄野四3等胚性愈伤组织形成能力较好的自交系, 可以通过优化培养基成分, 进一步提高转化效率。 ZmLEC1基因比对序列总长852 bp区间内共发现33个SNPs和9个InDels, 在整个基因序列内LD水平较高, 在大约300 bp处 R2衰减到0.1水平, ZmLEC1基因符合中性进化模型假设, 没有发生纯化选择。 ZmLEC1基因中有4个多态性位点与胚性愈伤组织形成显著关联。通过进一步开发功能标记, 并用于把优异等位基因向生产上应用自交系转移的育种程序, 将培育出适应我国不同玉米生态区的高转化效率自交系, 促进转基因玉米新品种培育。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|



 andr2 extends greater than 500 kbp in this germplasm. The presence of this exceptionally long segment of high LD may be suggestive of selection acting on one of the genes in the vicinity ofadh1 or of a locally reduced rate of recombination.
andr2 extends greater than 500 kbp in this germplasm. The presence of this exceptionally long segment of high LD may be suggestive of selection acting on one of the genes in the vicinity ofadh1 or of a locally reduced rate of recombination.